La apoptosis
de linfocitos como mecanismo de inducción de tolerancia con extractos
alergénicos.
Prof. F. Guerra
Pasadas.
Servicio de
Alergia
Hospital
Universitario Reina Sofía. Córdoba.
Nuestro grupo mantiene desde hace años,
como línea de investigación preferente el estudio de la inmunoterapia con
extractos alergénicos. Fruto de ello, ha sido la realización de varias tesis
doctorales, que se han plasmado en artículos científicos y comunicaciones a
congresos nacionales e internacionales (1,2,3,4,5). El objetivo fundamental de
estos trabajos, se ha centrado en la búsqueda de un parámetro biológico que nos
sirviera como control de eficacia, sin renunciar a profundizar en el mecanismo
de acción de este recurso terapéutico.
Experiencias previas sobre apoptosis en
otros modelos biológicos del grupo de investigación del Hospital Universitario
Reina Sofía, (6), nos hizo plantearnos si este mecanismo podía estar implicado
en el cambio de respuesta que experimentaban nuestros pacientes sometidos a
inmunoterapia.
Tras unos intentos fallidos, en los que
analizamos la apoptosis, a nivel de sangre periférica, de diferentes células:
linfocitos (T y B), monocitos y polimorfonucleares en pacientes sometidos a
inmunoterapia con extractos alergénicos (IT) en comparación con pacientes
alérgicos no tratados e individuos no alérgicos, nos centramos en el estudio,
como modelo biológico, de la apoptosis de linfocitos de pacientes y controles,
tras estimulación en cultivo con el antígeno al que estaban sensibilizados y recibiendo
en la IT.
Con este modelo pudimos demostrar que los
alérgenos de Olea europaea y Lollium
perenne, inducen
in vitro apoptosis en linfocitos CD4 + y CD45RO+ de individuos alérgicos
tratados con IT específica con los mismos alérgenos (7) y posteriormente que esta apoptosis es altamente específica del antígeno y que
afecta a los linfocitos Th2 productores de IL-4 (8). Por lo que hemos postulado que el mecanismo básico
por el que actúa la IT con extractos alergénicos se basa en que la estimulación
mantenida de las células memoria inmunocompetentes activa una cascada de
eventos intracelulares que llega a inducir la muerte por apoptosis en un
proceso denominado “muerte celular inducida tras activación” (AICD) que podría
estar ligado a un descenso en la actividad telomerasa de estas células que
evoca un mecanismo muy similar a la inmunodeficiencia asociada a la senescencia
(9).
Desde el punto de vista biológico la
Alergia es una respuesta T-mediada exacerbada ante una molécula (antígeno) inocua
para la mayoría de la población. Aunque no sabemos con certeza si es o no
inmunológica, la respuesta que pone en marcha un individuo normal ante estas
sustancias, lo cierto es que es inespecífica , puesto que no deja memoria y por
tanto no se sensibiliza.
La respuesta celular, se inicia con la fagocitosis del
alergeno por la célula presentadora de antígenos (APC) que lo presenta a un
linfocito Th0 como un péptido unido a un antígeno mayor de histocompatibilidad
de clase II, tras esa presentación se recibe una señal de la APC mediada por
citoquinas diferentes que dependen de la naturaleza del antígeno.
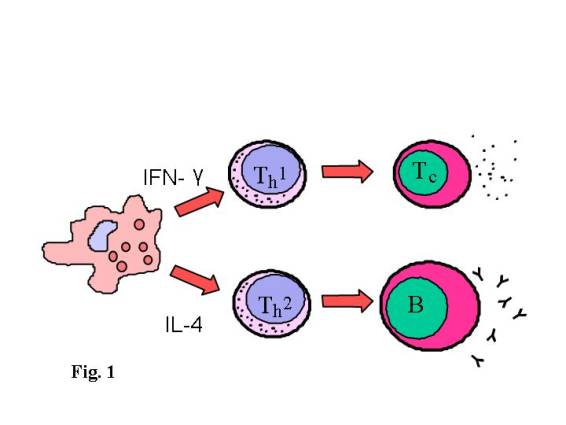
Fundamentalmente sabemos, que si predomina la producción de Interferón gamma
(IFN) se activarán y proliferaran linfocitos Th1 que a su vez activarán una
población de linfocitos T citotóxicos que serán la base de una respuesta inmune
celular dirigida contra el antígeno. Si la citoquina predominante es la IL-4,
en este ambiente, se activarán linfocitos Th2 que actuarán sobre linfocitos B
que se transforman en células plasmáticas dando lugar a la producción de
anticuerpos específicos dependiendo del tipo de antígeno, es esta una respuesta
humoral, que en el caso de la respuesta alérgica es del isotipo IgE. (Fig. 1).
El fenotipo Th1 viene caracterizado por
múltiples citoquinas, pero las más importantes son IL-1, IL-2, IFN y TNF y en
la respuesta Th2 igualmente participan varias citoquinas, pero las más
importantes son IL-4 e IL5.
Es la persistencia del antígeno lo que
permite que la señal continúe, haciendo que tras la activación Th2 se origine
la proliferación celular, quedando un clon de células con memoria específica
del antígeno que las ha originado. Ante un nuevo contacto (Fig. 2), estos linfocitos Th2 producen la IL-4 que
actuando sobre los linfocitos B, a través del receptor específico, lo activa
transformándolo en una célula plasmática que sintetiza anticuerpos IgE
específicos.
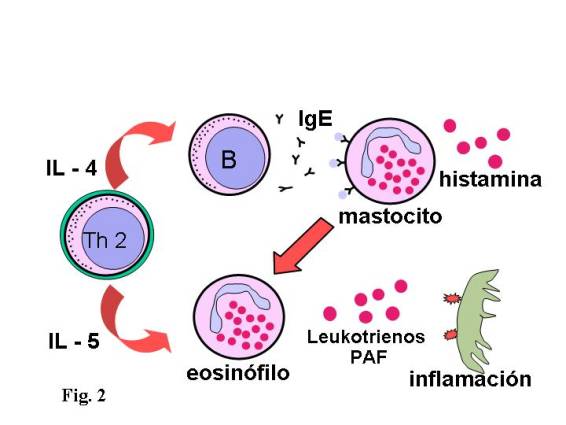
Estos anticuerpos ligados al mastocito, a través de su
fragmento Fc, captan al antígeno. El antígeno, con al menos dos epítopos, es
capaz de unir en la membrana de la célula diana dos moléculas de IgE, este
entrecruzamiento o banding es lo que produce la activación del mastocito dando
lugar a la liberación de mediadores, como respuesta inmediata, que genera un fenómeno
inflamatorio de mayor o menor intensidad dependiendo de la hiperreactividad del
órgano de choque. Al mismo tiempo es el propio linfocito Th2, a través de la
producción de IL-5, actuando principalmente sobre el eosinófilo, junto a
mediadores quimiotácticos para polimorfonucleares, el responsable de la fase
tardía de la reacción inflamatoria y del daño epitelial, con infiltrado de
eosinófilos y neutrófilos y depósito de fibrina. Para el desarrollo de cada uno
de estos acontecimientos biológicos es indispensable la participación de las
moléculas de adhesión.
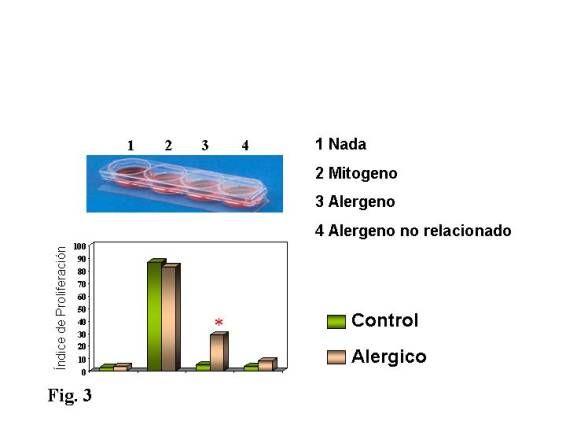
Pero como vemos en la Fig. 3, el paciente alérgico no es hiperrespondedor
inespecífico, ya que ante el estímulo de un mitógeno como la fitohemaglutinina
(PHA) responde con la misma intensidad que el control no alérgico, sino que
tiene una hiperrespuesta altamente específica, no respondiendo, al igual que el
control, a un alergeno al que no está sensibilizado.
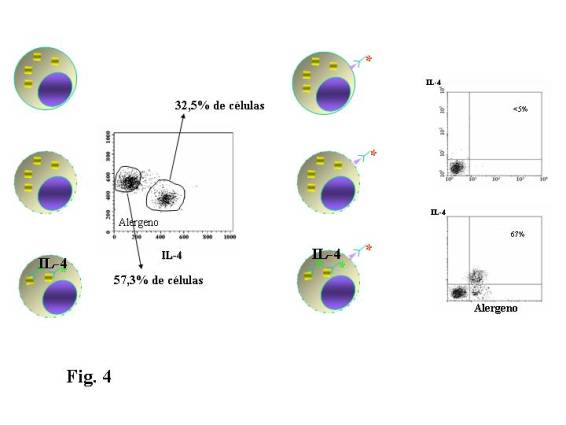
Si analizamos las células que han
proliferado en el cultivo de linfocitos, tras estímulo con PHA valorando las
citoquinas intracelulares, (utilizando una solución permeabilizante de la
membrana celular y anticuerpos monoclonales anti IL-4), vemos mediante
citometría de flujo que el 32.5 % de las células que han proliferado son
productoras de IL-4 y si se estimulan con el alergeno este porcentaje pasa al
57.3 %. Así mismo si fijamos las células con el alergeno, vemos mediante
citometría de flujo que de las células que fijan el alergeno el 67 % producen
IL-4 en contraste con el 5 % en el grupo control de células que no fijan el
alergeno (Fig. 4), lo que pone de manifiesto que
en el paciente alérgico los linfocitos Th2 productores de IL-4 se activan y
proliferan de forma específica frente al alergeno.
¿Esta célula es clave en la respuesta
alérgica por ser hipeproductora de IL-4 o por otra propiedad biológica?.
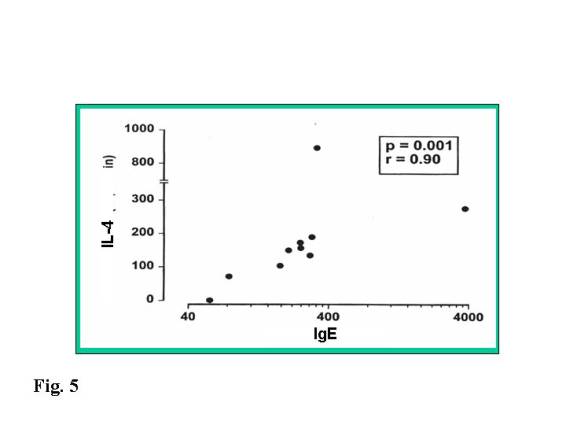
Sabemos que existe una fuerte correlación entre IL-4 y producción de IgE
específica (Fig. 5) por lo que parece que lo
importante es la interleuquina, sin embargo el aspecto central de la respuesta
biológica que estamos analizando es el conjunto Th2-interleuquina.
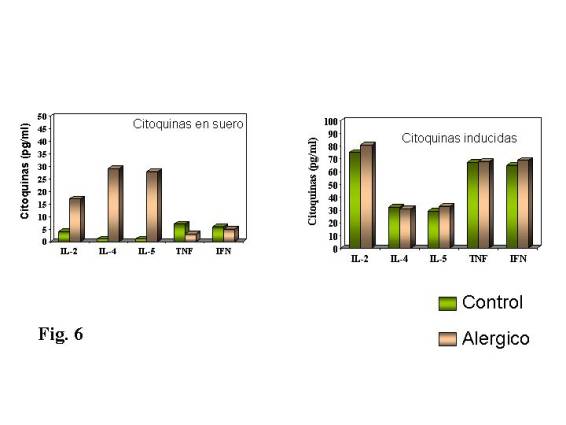
Nosotros podemos valorar el perfil de
citoquinas, en el suero de los individuos, para caracterizar una respuesta. En
el paciente alérgico en comparación con el individuo control no alérgico,
encontramos un incremento significativo de IL-2, IL-4 e IL-5, que definen un
perfil Th2, no encontrando diferencias en el nivel de factor de necrosis
tumoral (TNF) e interferón (IFN) que definen un perfil Th1. El mismo perfil de
linfoquinas lo podemos valorar en cultivo de células inducido por PHA, como
vemos en la Fig. 6. Podemos observar cómo no
existe diferencia en el nivel de las distintas interleuquinas en el
sobrenadante del cultivo tras estimulación con PHA en los pacientes alérgicos y
los controles, es decir las células de nuestros pacientes tienen la misma
capacidad para producir cualquier tipo de citoquina, no solo las que configuran
un perfil Th2.
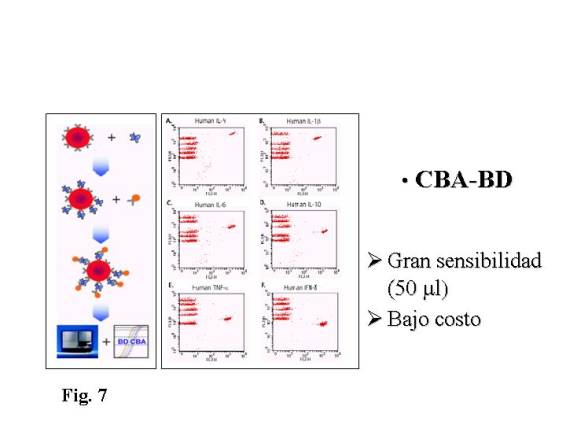
Un problema importante que encontramos en
la valoración de citoquinas, es que los métodos clásicos (ELISA, IRMA...) solo
permiten determinar citoquinas solubles en grandes volúmenes (ml) y son poco
sensibles. Por otra parte numerosas patologías (infecciones, inflamaciones...)
alteran en un momento dado el patrón de citoquinas séricas, por ello nuestro
grupo utiliza como método el CBA-BD (Citometry Bead analisys) que es un
micrométodo que ha demostrado una gran sensibilidad y bajo costo y permitiendo
procesar muestras de hasta 50 ul.
El CBA-BD (Fig.
7) utiliza unas microesferas de diferentes colores, cada color lleva fijado un
anticuerpo anti-interleuquinas distinto. Nosotros las incubamos con el suero
del paciente, las interleuquinas se fijan a su anticuerpo y posteriormente añadimos
un anticuerpo marcado con un fluorocromo. Nosotros valoramos las esferas por
citometría de flujo como si fueran células y el color y la fluorescencia
determinan el tipo de interleuquina, permitiendo la valoración de hasta 6
interleuquinas en un mismo ensayo, con 50 ml de muestra, lo que permite valorar
interleuquinas no solo en sangre sino en otros fluidos biológicos como saliva,
moco, lágrimas, etc... y su utilización de forma más rutinaria.
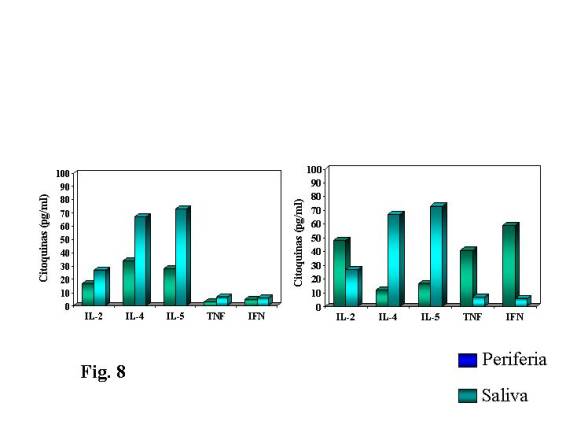
Con este método hemos podido observar
cómo, en la valoración de distintas interleuquinas en nuestros pacientes alérgicos,
el perfil Th2 se manifiesta más claramente en saliva que en el suero, como
vemos en la Fig. 8. Así mismo observamos el caso
de un paciente que por tener una infección concomitante, tenía elevado en
sangre el TNF e IFN (perfil Th1) lo que no ocurre en la valoración en la
secreción salival. Con un método clásico esta diferenciación no hubiese sido
posible.
Es un hecho conocido que los pacientes
alérgicos presentan un disbalance Th1/Th2 con incremento de citoquinas Th2 y
que este disbalance se corrige con la inmunoterapia (10,11). ¿Qué correlación
existe entre la Biología Celular que hemos analizado y la inmunoterapia con
extractos alergénicos?.
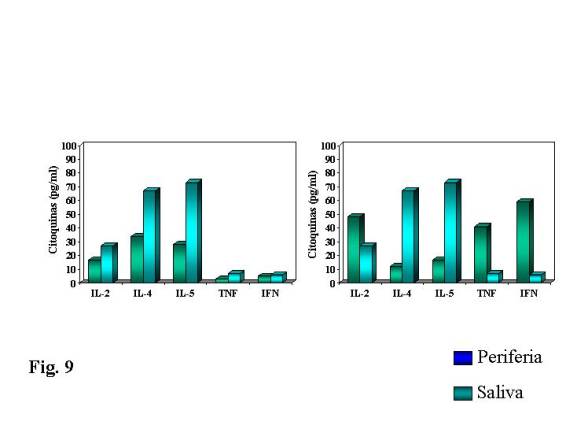
Nosotros hemos observado, midiendo las
diferentes interleuquinas a nivel intracelular, en un grupo de 20 pacientes
alérgicos en tratamiento con IT a Olea y
Lollium, comparándolo con un grupo
control de igual número con idéntica sensibilidad y 10 controles no alérgicos (Fig. 9), que existen diferencias estadísticamente
significativas tras estimulo con el alergeno al que están sensibilizados, en
los niveles intracelulares de IL-4 e IL-5, en pacientes con y sin IT,
disminuyendo estos niveles en los pacientes con IT hasta ser similar a los
controles no alérgicos. Así mismo se objetiva una disminución en la
proliferación celular en los pacientes con IT, si embargo al estimular
inespecíficamente con PHA el comportamiento es similar en los tres grupos.
Es decir, en los pacientes sometidos a IT
con extractos alergénicos bien estandarizados, tras estimular sus linfocitos
con el antígeno que están recibiendo en el tratamiento se objetiva una
disminución en la proliferación celular y un descenso de las citoquinas de
perfil Th2 intracelulares, ¿A qué se debe este cambio biológico?, ¿Cuál es el
mecanismo de acción de la inmunoterapia?.
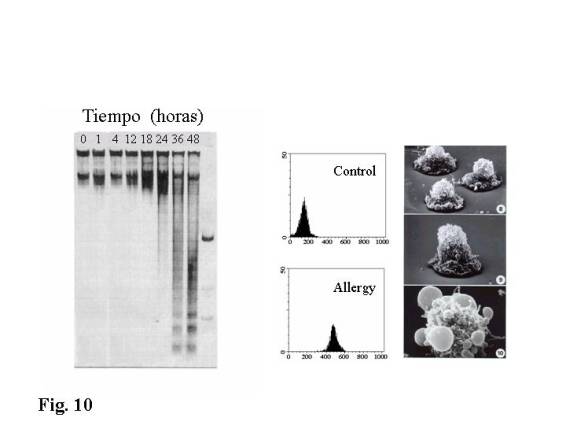
Pudimos observar mediante electroforesis
del DNA en gel de agarosa en distintos tiempos el típico patrón en escalera del
DNA degradado al valorar los linfocitos de los pacientes sometidos a IT, lo que
no ocurría con los pacientes alérgicos no tratados y los controles, igualmente
lo objetivamos mediante otros dos métodos que valoran apoptosis (Citometría de
flujo y microscopía electrónica de barrido) (Fig.
10). Es decir los linfocitos de los pacientes alérgicos sometidos a IT,
entraban en un proceso de apoptosis, al ser estimulados con el antígeno y este
porcentaje de apoptosis era claramente diferente a los controles.
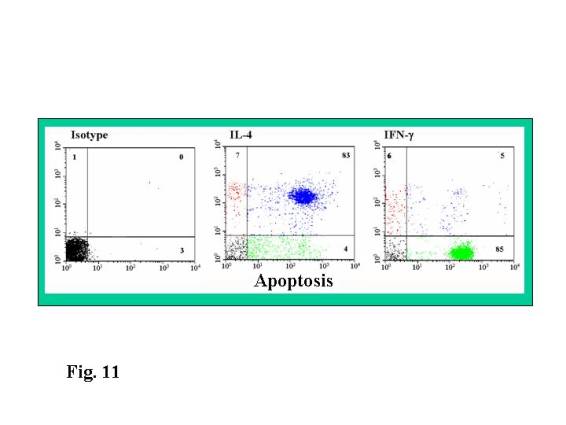
Posteriormente empleamos como marcador de
apoptosis la Anexina V. Esta técnica se basa en que al originarse la apoptosis
se altera la membrana celular de forma temprana (12), afectando a los
fosfolípidos, exponiéndose al exterior la anexina que puede ser marcado con
moléculas conjugadas con fluorocromos, esto permite a su vez el marcaje de las
células con un anticuerpo para caracterizarlas (Fig.
11). Empleamos anticuerpos anti- IL-4 y anti- IFN y pudimos demostrar que las
células que morían por apoptosis eran IL-4 +.
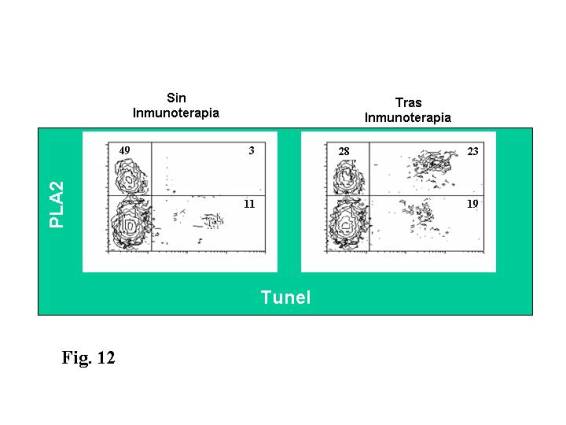
Para demostrar que las células Th2 que
iban desapareciendo mediante el mecanismo de apoptosis eran específicas del
antígeno, estudiamos el modelo de IT a veneno de himenópteros que nos permitía
utilizar un antígeno mejor caracterizado y fácil de manejar como es la
fosfolipasa A2 (PLA2). No pudimos emplear el método de la Anexina V para
valorar la apoptosis ya que al ser ambos de naturaleza fosfolipídica producía interferencias
técnicas, empleando en este caso el método TANEL ( Tdt-mediated X-dUTP nick end
labeling) (Boehringer Mannheim) que aprovecha la fragmentación del DNA,
marcando cada fragmento terminal con una desoxinucleotidil transferasa terminal
modificada (10) (Fig. 12) poniéndose en
evidencia que solo se objetivaba apoptosis en las células marcadas con PLA2 de
los pacientes que estaban recibiendo inmunoterapia y no en los pacientes
alérgicos a veneno de himenópteros no tratados. (13)
Nuestros hallazgos, por tanto, parecen
demostrar que el mecanismo por el que puede actuar la IT específica con
extractos alergénicos, puede deberse a que el estímulo antigénico mantenido y a
dosis suficientes, está eliminando el clon de células respondedoras Th2
específicas del antígeno, actuamos a nivel central produciendo una
inmunotolerancia. Estamos cortando la respuesta biológica específica, hecho que
ha tenido repercusión en la bibliografía especializada (14)
Esto tiene una trascendencia clínica
evidente ya que, en determinados modelos de IT, nos permitiría valorar la
eficacia y monitorizar la cinética de los cambios. En otros modelos como la
polinosis, la mono o polisensibilidad y la posibilidad de reactividad cruzada,
hace que la eficacia de la IT pueda ser muy variable, pero el mecanismo parece
ser muy selectivo.
La complejidad de los diferentes métodos
para valorar apoptosis, hace que desde el punto de vista del laboratorio
busquemos otros modelos de trabajo para valorar tanto la eficacia de la IT en
nuestros pacientes como la posibilidad de prever aquellos pacientes que pueden
tener reacciones adversas a la misma.
Actualmente podemos valorar la cinética
de los cambios en el perfil Th1/Th2 mediante la determinación de citoquinas
solubles a nivel sérico y local (moco, lágrimas, saliva) mediante el CBA-BD y
tras activación y proliferación celular frente al alergeno, pero las
enfermedades alérgicas tienen un componente genético importante, no existen
estudios concluyentes de alteraciones genéticas asociadas a las enfermedades
alérgicas por lo que cabe plantearse si el polimorfismo génico de citoquinas
puede condicionar la respuesta al alergeno y/o a la inmunoterapia, tanto desde
el punto de vista de la eficacia como de la tolerancia a la misma.
BIBLIOGRAFIA
1)
Linear monitoring of patients
sensitive to olea and gramineal pollens treated with immunotherapy based on
glutaraldehide-modified (Allergoid) extracts. Guerra F.
Moreno C., Daza JC., Miguel R., García M., Sanchez Guijo P. J. Invest. Allergol Clin Inmunol 3:182, 1993.
2)
Linear monitoring during 4 years of
immunotherapy in pollinosis (Allergoid VS. U.B. Retard Extract) Guerra F., et
al. Allergy 16:67, 1993.
3)
Initial
evaluation of follow-up index for immunotherapy in patients allergic to
gramineae. Arenas A., Guerra F., Daza JC., Miguel
R., Aviles C., Sanchez Guijo P.. Allergy. 48-16:66, 1993.
4)
Inmunoterapia con un extracto de
alternaria en el asma infantil. Eficacia clínica, seguridad, repercusiones
sobre parámetros in vivo e in vitro. A Criado, F. Guerra Pasadas y otros. Allergol et Inmunopathol. 30(6): 319-
5) Immunotherapy with Depigmented Polymerized vaccine of Olea europaea significantly reduces specific bronchial and skin test reactivity in sensitizad patients after one year of treatment. Francisco guerra, Juan Carlos Daza, Aduardo Almeda. Journal of Invest. Clin Inmunol. Acept. (en prensa)
6)
Mycobacterium tuberculosis induces
apoptosis in cells from patients with advanced clinical forms of active
tuberculosis. Ramirez R. Clin. Diag Lab Immunol. 4:11, 1997.
7)
Allergens induce apptosis in
Lymphocytes from atopic patients. Francisco Guerra, Julia Carracedo, Juan
Antonio Madueño, Pedro Sanchez Guijo y Rafael Ramirez. Human Immunology 60:840, 1999.
Th2 lymphocytes from atopic patients
treated with immunotherapy undergo rapid apoptosis after culture with specific
allergens. Francisco Guerra, Julia Carracedo, Rafael Solana-Lara, Pedro
Sanches Guijo and Rafel Ramirez. J. Allergy Clin
Immunol. 107 (4): 647. 2001.
8)
Telomeres in T and B cells. Hodes RJ, Hathcock KS, Weng NP. Nat Rev
Immunol. 2002;2(9):699-706
9)
The kinetics of change in cytokine
production by CD4 T cells during conventional allergen immunotherapy. Benjaponpitak S, Oro A, Maguire P,
Marinkovich V, DeKruyff
RH, Umetsu DT. J Allergy Clin Immunol. 1999;103(3):468-75.
10) Specific immunotherapy prevents increased levels of allergen-specific
IL-4- and IL-13-producing cells during pollen season. Gabrielsson S, Soderlund A, Paulie
S, van der Pouw Kraan TC, Troye-Blomberg M, Rak S. Allergy. 2001;56(4):293-300.
11) A novel assay for apoptosis: flow cytometric detection of
phosphatidilserina expression on early apoptotic cell using fluorescein
labelled Annexin V. Vermes I, Haanen C, Steffens-Nakken H., Reutelingsperger C.
J. Immunol Methods. 184:339, 1995.
12)
Induction of replicative senescence
in allergen responder cells: A role for an immunotherapy mechanic. Moreno C., Guerra F., Carracedo J, Jimenez R.,
Sanchez Guijo P, Ramirez R. (en prensa)
13) Allergy immunotherapy and inhibition of Th2 immune responses: a
sufficient strategy?. Lewis DB. Curr Opin Immunol. 2002;14(5):644-51.